A fotometria, que mede a absorbância de uma solução, é um dos métodos de análise por microplacas mais utilizados, tanto na pesquisa quanto em setores como controle de qualidade e análises clínicas. Ela se baseia no conceito de que qualquer luz incidida sobre uma solução será parcialmente absorvida pelos compostos contidos nessa solução, e que essa absorção é diretamente proporcional à concentração desses compostos.
Para fazer uma comparação, podemos nos lembrar de sucos diluídos e concentrados. Quanto mais diluído um suco está, mais luz passa pela jarra onde ele se encontra, permitindo que vejamos melhor o lado oposto ao recipiente. No entanto, quando o suco está concentrado, torna-se mais difícil enxergar através da jarra, e assim instintivamente já sabemos qual a jarra que contém o suco mais concentrado. Esse é exatamente o princípio da fotometria, que se utiliza de equipamentos que possam quantificar quanto da luz incidida passa pelo recipiente (neste caso, o poço da microplaca) e quanto dela é absorvida pela solução.

Uma forma de otimizar essa análise é utilizar luz com cores definidas, já que cada composto possui uma cor específica que é capaz de absorver com maior intensidade. Essas cores são definidas por uma característica da luz chamada comprimento de onda, medido em nanômetros (nm). A luz visível, por exemplo, possui comprimentos entre 400 e 700 nm, sendo que abaixo disso está o espectro ultravioleta e acima o infravermelho.
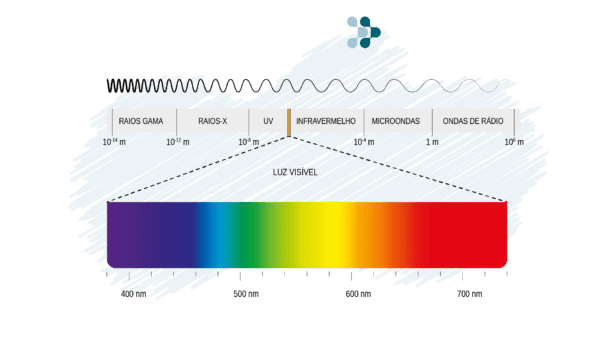
Nesse contexto, cada região do espectro eletromagnético é utilizada para um tipo de análise diferente. A fotometria abrange tipicamente os comprimentos de onda de 200 a 1000 nm.
Agora que já entendemos esses conceitos, é necessário selecionar o comprimento de onda que será utilizado no ensaio.
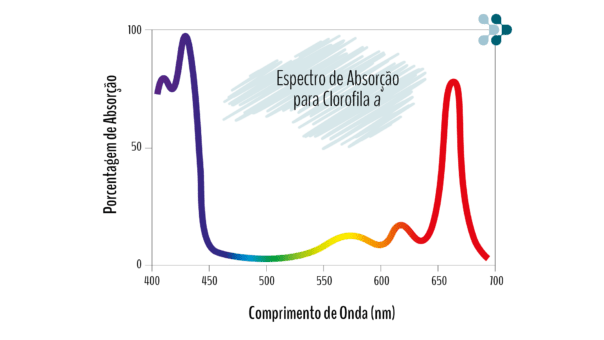
O composto colorido que queremos identificar, chamado cromóforo, pode absorver vários comprimentos de onda, mas o pico dessa absorção será na cor oposta à sua própria. Isso quer dizer, por exemplo, que um composto verde irá absorver mais luz do comprimento de onda vermelho, sua cor oposta, do que de outros comprimentos de onda.
Geralmente essas informações estão presentes na literatura, mas se você quiser verificar por você mesmo, basta realizar em seu leitor uma varredura espectral, que irá ler a absorbância em vários comprimentos de onda e você poderá observar o gráfico desse resultado para identificar onde está o pico de absorção.
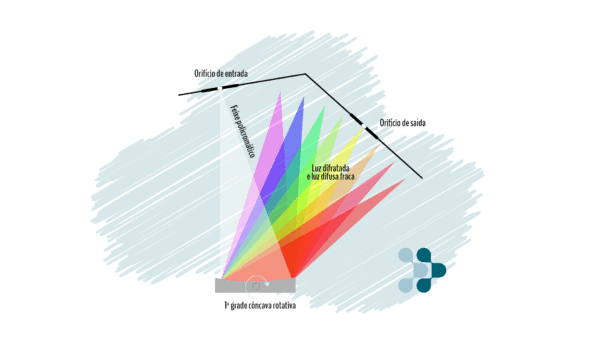
Filtros versus Monocromadores
A seleção do comprimento de onda pode ser feita utilizando filtros ou monocromadores. Os filtros selecionam um comprimento de onda específico quando um raio de luz os atravessa, enquanto o monocromador é capaz de “abrir” a luz branca (geralmente gerada por uma lâmpada de xenônio) como um prisma. Como o monocromador é instalado sobre um pivô, o equipamento é capaz de rotacioná-lo para que a cor de interesse seja direcionada por um orifício e, só então, incida sobre a amostra, como esquematizado na Figura 4. Assim, é possível selecionar qualquer comprimento de onda dentro do espectro contido na luz branca da lâmpada de xenônio, tipicamente de 200 a 1000 nm.
Obtendo a concentração a partir da absorbância
Uma vez que já sabemos o comprimento de onda que será utilizado, podemos analisar a relação entre a concentração e absorbância. É aí que entra a famosa Lei de Lambert-Beer, que nos mostra que a absorbância é um produto da concentração, do caminho óptico e de uma característica da solução chamada absortividade. O caminho óptico é a distância que a luz percorre dentro da solução e, no caso das microplacas, é a altura da solução no poço.
Para facilitar a parte matemática do ensaio, utiliza-se um mesmo caminho óptico dentro de um mesmo ensaio, ou seja, o mesmo volume em cada poço da placa. Mantendo o caminho óptico constante e trabalhando com o mesmo cromóforo, toda variação da absorbância será devida à concentração da solução em cada poço, permitindo análises lineares.
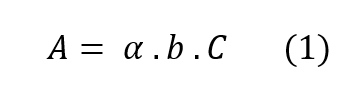
A lei de Lambert-Beer possui limitações, perdendo a linearidade em concentrações muito altas ou muito baixas, mas nesses casos, como as outras variáveis continuam constantes em nossos ensaios, basta utilizar regressões não lineares que possam descrever aquela curva. Diversas opções de regressões não lineares estão disponíveis nos softwares de análise, e a mais utilizada é a regressão de quatro parâmetros, ou 4PL.
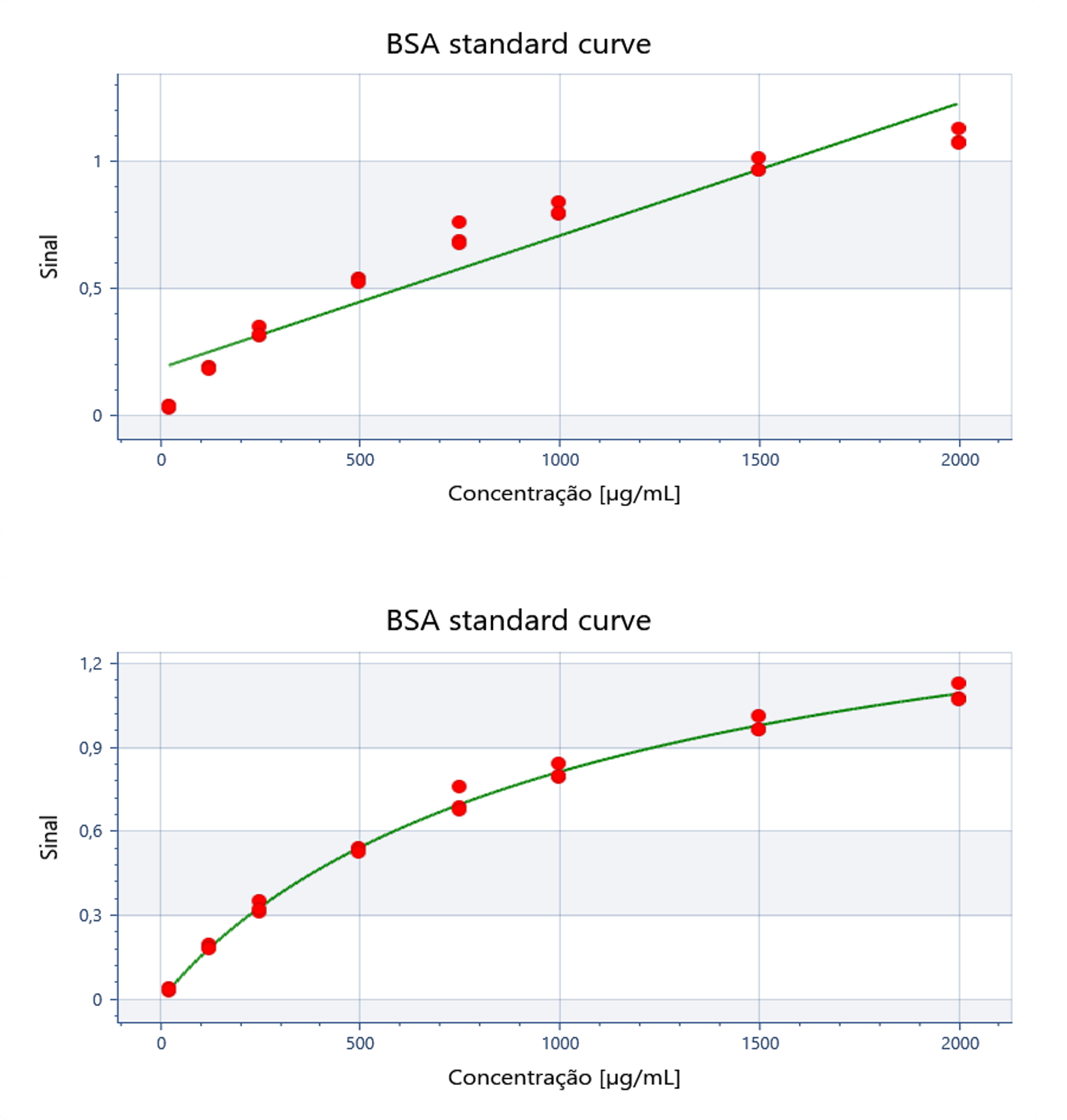
Uma vez obtida a curva que descreve o comportamento da Absorbância de acordo com a concentração da solução, podemos quantificar qualquer amostra que esteja dentro dos limites da curva utilizada. Isso é feito utilizando a equação da curva, substituindo o valor de absorbância lido e obtendo a concentração ao resolver a equação. Essa é a base para diversos métodos, como Bradford, Lowry, BCA e ELISA quantitativo.
Outras aplicações
Quantificação de DNA no UV
Os ácidos nucleicos e alguns aminoácidos possuem pico de absorção no espectro UV, a 260 e 280 nm, respectivamente. Utilizamos essas características para quantificar DNA, RNA e proteínas purificadas sem a necessidade de utilizar marcadores e reagentes. Essa quantificação, no entanto, não pode ser realizada em recipientes de plástico tradicional, sendo necessário o uso de quartzo ou poliestireno modificado (poliestireno transparente ao UV ou UVT).
Leitores de microplacas costumam ter como acessório uma placa de metal com duas lâminas de quartzo e uma película que forma micropoços de 2 a 10 µl.
Ao pipetar sobre os poços da película, são formadas gotas de amostra, que por sua vez são prensadas entre as duas lâminas de quartzo formando um caminho óptico preciso e constante em todos os poços. E como a absortividade do DNA e do RNA são conhecidas, basta aplicar a lei de Lambert-Beer para obter a concentração de ácido nucleico na sua amostra.

Outra informação que podemos obter na leitura UV é a pureza da amostra, que verifica se a extração foi realizada de forma satisfatória, já que proteínas e compostos fenólicos podem acabar sendo extraídos junto com o DNA ou RNA por ligações não específicas e por arraste. Para isso utilizamos as relações abaixo:

A princípio, o ideal é que essas purezas estejam próximas de 1,8, mas como certas extrações são mais desafiadoras do que outras, esse valor de referência varia de acordo com o laboratório, a matriz de extração e o processo utilizado.
As limitações da quantificação de ácidos nucleicos no UV são sua baixa especificidade – geralmente a concentração é superestimada – e baixa sensibilidade. Quando essas características se tornam um problema, como ao analisar níveis de expressão gênica, utilizam-se técnicas de fluorescência para a quantificação.
Ensaios de toxicidade com MTT
Ensaios de toxicidade são importantes para encontrar compostos que possam inibir o crescimento de um microrganismo ou cultura celular. A ideia é verificar as concentrações que são capazes de inibir esse crescimento, e compará-las com compostos que conhecidamente possuem ação eficiente nesse ensaio. Para uma comparação da eficácia, é comum identificar o IC50 ou EC50: a concentração necessária do seu composto analisado para alcançar 50% da ação de um composto de referência.
Essa análise pode ser realizada facilmente utilizando o software SkanIt, para leitoras de microplaca Thermo Scientific. Conheça o processo no vídeo abaixo.
Ensaios cinéticos e enzimáticos
Ensaios cinéticos são aqueles em que agendamos o equipamento para que faça leituras programadas a cada certo período para acompanhar a evolução de uma reação ou crescimento pela variação de absorbância de um certo poço ao longo do tempo. Por isso, a análise é feita sobre curva absorbância x tempo, formada a partir dessas leituras, e a variável mais comumente avaliada é a velocidade máxima da reação. As aplicações variam de taxas de crescimento bacteriano à descrição cinética de uma enzima, podendo se estender por diversos campos de estudo.
A fotometria é uma técnica flexível e acessível, utilizada em larga escala por todo o mundo. Esse artigo cobre seus pontos básicos, mas se você tiver qualquer dúvida, fique à vontade para acionar nossa equipe de assessoria científica. Estamos à disposição para auxiliá-lo.